
No pocas veces nos hemos podido preguntar que, dadas las que imperaban en la Tierra hace cuatro mil millones de años, ¿que probabilidades había de que surgiera la vida?
Lo más fácil sería responder que la Vida era inevitable, como lo demuestra el simple hecho de que nosotros estemos aquí.
Es obvio que la vida sí se inicio y que nuestra presencia la testifica pero, ¿tenía que iniciarse? O, preguntado de otra manera, ¿era inevitable la emergencia de la vida a partir de un caldo químico o cualquier otra cosa, contando con millones de años?
Nadie conoce la respuesta a esa pregunta. El origen de la vida haber sido también, una extraordinaria “carambola”, un accidente químico de enorme improbabilidad, un suceso tan poco probable que nunca sucedería dos veces en todo el universo.
O quizá haya sido tan poco notable y tan predeterminada como la formación de los cristales de sal.
¿Cómo podemos saber que explicación es la correcta?

En algún momento del pasado de la Tierra, estimado en aproximadamente 2.500 – 3.500 millones de años, tuvo lugar lo que denominamos revolución oxigénica, durante la cual las cianobacterias produjeron tanto oxígeno que la atmósfera y los océanos quedaron literalmente saturados de este compuesto químico. Tal producción de oxígeno afectó drásticamente a la biósfera del planeta.
Antes de la revolución oxigénica, pocos organismos estaban adaptados para vivir en presencia de oxígeno abundante; las moléculas de oxígeno actuaban como un veneno, reaccionando con las moléculas orgánicas complejas y degradándolas. Debido a esto, la mayor parte de la vida existente en ese momento debió quedar exterminada; las cianobacterias serían responsables de una gran extinción masiva.
Sabemos que la vida terrestre está basada en algunas moléculas muy complicadas con estructuras cuidadosamente elaboradas, incluso en los organismos simples, el ADN contiene millones de átomos.
La secuencia exacta de los átomos es crucial. No se tener una secuencia arbitraria porque el ADN es un manual de para conseguir un organismo y, si cambiamos algunos átomos se pondrá en peligro toda la estructura del organimo
.Claro que pensar en manejar aminoácidos al azar y obtener la secuencia correcta para formar una molécula de proteína por accidente…es complicado.
Las probabilidades en contra de producir las proteínas por puro azar son del orden de 1040000 contra 1 seguido de cuarenta mil ceros, cuya escritura completa necesitaría de muchas hojas en blanco para ser reflejada. Fred Hoyle, siempre hacía comparación: “Un ensamblaje expontáneo de la vida sería lo mismo y tendría las mismas probabilidades que si un Tornado barriera un depósito de chatarra y produdujera un Boeing 747 listo para funcionar.

No sabemos que objetos y qué cosas se pueden formar aquí en el medio interestelar en el que se han descubiertos moléculas sorprendetes y hasta aminoácidos y azúcares necesarios para la vida, o, incluso fullerenos y otros elementos que han sorprendido a los científicos que no imaginaron nunca que puedieran estar ahí presente. Nunca podremos llegar a saber de lo que es capaz la Naturaleza.
La inmensa complejidad que el misterio de la vida conlleva, nos ha llevado a pensar en la posilidad extraterrestre y en otros múltiples modelos que, de alguna manera, nos puedieran alcarar ese origen que tan afanosamente buscamos sin éxito…de momento.
Algunas personas sienten que algo tan básico como nuestra propia existencia no puede deberse a un azar químico, y que barrer el problema bajo la alfombra con la palabra “accidente” es una manera de escabullirse.
A veces se cita el principio de mediocridad: no hay nada especial o excepcional en nuestro lugar en el Universo. La Tierra parece un planetas típico alrededor de una estrlla típica en una galaxia típica. Si eso es así (que lo), ¿por qué no sería, también típica la vida en la Tierra?
Pero, a todo esto, por mucho que hayamos podido elucubrar sobre el tema, lo cuaeto es que, no podemos contestar la pregunta: ¿Por qué y cómo realmente, llegamos aquí, y, si tambie´n podemos estar en otros mundos?
La enorme variedad de formas, colores, comportamientos, composición…, que acompaña a los objetos, incluidos los vivientes, sería una consecuencia de la riqueza en la información que soportan las moléculas (y sus agregados) que forman parte de dichos objetos.
Ello explicaría que las moléculas de la vida sean en general de grandes dimensiones (macromoléculas).
La inmensa mayoría de ellas contiene carbono. Debido a su tetravalencia y a la gran capacidad que posee dicho átomo para unirse consigo mismo, dichas moléculas pueden considerarse como un esqueleto formado por cadenas de esos átomos.

El carbono no es el único átomo con capacidad para formar los citados esqueletos. Próximos al carbono en la tabla periódica, el silicio, fósforo y boro comparten con dicho átomo esa característica, si bien en un grado mucho menor.
Refiriéndonos al silicio, señalaremos que las “moléculas” que dicho átomo forma con el oxígeno y otros átomos, generalmente metálicos poseyendo gran nivel de información, difieren en varios aspectos de las moléculas orgánicas, es decir, de las que poseen un esqueleto de átomos de carbono.

En el Universo podemos encontrar muchas cosas pero, cada día estoy más convencido de que nunca encontraremos formas de vida que no esté basada en el Carbono.
No creo que sea una casualidad que en la Tierra, donde hemos llegado a conocer millones de especies vivas, muchas de ellas extinguidas ya, y, muchas otras que conviven con nosotros y que, sin excepción, todas están basadas en el Carbono.
Si acaso, dejo la puerta abierta a la vida de Silicio artificial.
El silicio púede econfigurar muchas formas y, no creo que entre ellas se puedan encontrar las vivientes, ya que, el átomo de silicio no llega a tener las amplias propiedades que tiene el Carbono.
Sin embargo, no son pocos los que opinan que puede existir alguna clase de vida basada en el silicio y, desde luego, aunque no lo crea probable tampoco tengo conocimientos suficientes para poder negarlo. ¿quién sabe lo que por ahí fuera pueda existir en esos mundos perdidos en la lejanía del espacio?
El mundo de los silicatos es de una gran diversidad, existiendo centenares de especies minerológicas. Esas diferencias se refieren fundamentalmente a que el enlace químico en el caso de las moléculas orgánicas es covalente, y cuando se forma la sustancia correspondiente (cuatrillones de moléculas) o es un líquido, como es el caso de los aceites, o bien un sólido que funde fácilmente.
Entre las moléculas que lo forman se ejercen unas fuerzas, llamadas de Van der Waals, que pueden considerarse como residuales de las fuerzas electromagnéticas, algo más débiles que éstas.
En cambio, en los silicatos sólidos (como en el caso del topacio) el enlace covalente o iónico no se limita a una molécula, sino que se extiende en el espacio ocupado por el sólido, resultando un entramado particularmente fuerte.

Al igual que para los cristales de hielo, en la mayoría de los silicatos la información que soportan es pequeña, aunque conviene matizar este punto. Para un cristal ideal así sería en efecto, pero ocurre que en la realidad el cristal ideal es una abstracción, ya que en el cristal real existen aquí y allá los llamados defectos puntuales que trastocan la periodicidad espacial propia de las redes ideales. Precisamente esos defectos puntuales podían proporcionar una mayor información.

Nanotubos de carbono
Si prescindimos de las orgánicas, el resto de las moléculas que resultan de la combinación entre los diferentes átomos no llega a 100.000, frente a los varios millones de las primeras. Resulta ranozable suponer que toda la enorme variedad de moléculas existentes, principalmente en los planetas rocosos, se haya formado por evolución de los átomos, como corresponde a un proceso evolutivo.
La molécula poseería mayor orden que los átomos de donde procede, esto es, menor entropía. En su formación, el ambiente se habría desordenado al ganar entropía en una cierta cantidad tal, que arrojarse un balance total positivo.
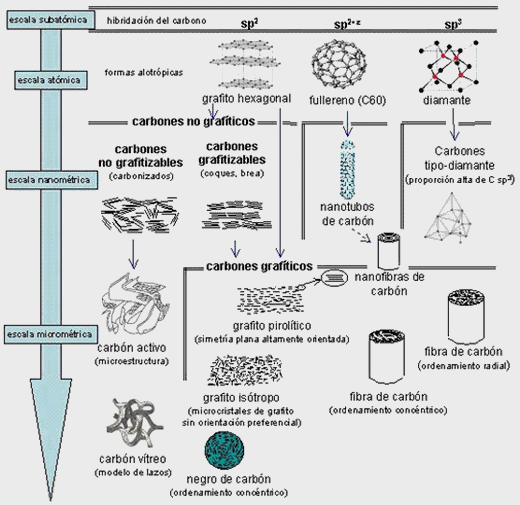
El Carbono es tan importante en nuestras vidas que, incluso podría incidir en nuestro futuro.
No puedo dejar pasar la oportunidad, aunque sea de pasada, de mencionar las sustancias.
Las así llamadas, son cuerpos formados por moléculas idénticas, entre las cuales pueden o no existir enlaces químicos. Veremos varios ejemplos.
Las sustancias como el oxígeno, cloro, metano, amoniaco, etc, se presentan en estado gaseoso en condiciones ordinarias de presión y temperatura.
Para su confinamiento se embotellan, aunque existen casos en que se encuentran mezcladas en el aire , como en la imagen que sigue.

En lugares como este, podemos encontrar los más variados elementos y sustancias que la química estelar ha elaborado para que sea posible que esa dinámica universal nos lleve hasta la vida.
La radiación ultravioleta de las estrellas jóvenes masivas que surgen de estas inmensas nebulosas ionizan los átomos del material circundante que brillan.
Los vientos estelares conforman figuras extrañas y a veces adquieren una exótica belleza conformando figuras increíbles.
La química no es una exclusiva de los tubos de ensayo de los laboratorios. Acordaos de que ya en 1969 fueron descubiertas moléculas de amoniaco y agua en el espacio exterior. ¿Cómo llegaron allí?
Los astrónomos saben desde hace mucho tiempo que el espacio no está completamente vacío, Los vacíos interestelares contienen nubes más o menos densas de gas y polvo en las que nacen las estrellas y los mundos y, las energías presentes por medio de vientos estelares, radiación UV y la Gravedad, hace que transformaciones químicas se produzcan para cambiar unos elementos sencillos en otros más complejos.
El espacio, por su contenido, las fuerzas y energías y la gravedad que están presentes, es como un inmenso laboratorio espacial en el que ocurren cosas…interesantes. Las Nebulosas son criaderos de estrellas y…mucho más.
En cualquier caso, un gas como los citados consiste en un enjambre de las moléculas correspondientes. Entre ellas no se ejercen fuerzas, salvo cuando colisionan, lo que hacen con una frecuencia que depende de la concentración, es decir, del número de ellas que están concentradas en la unidad de volumen; número que podemos calcular conociendo la presión y temperatura de la masa de gas confinada en un volumen conocido.
Decía que no existen fuerzas entre las moléculas de un gas.
En realidad es más exacto que el valor de esas fuerzas es insignificante porque las fuerzas residuales de las electromagnéticas, a las que antes me referí, disminuyen más rápidamente con la distancia que las fuerzas de Coulomb; y esta distancia es ordinariamente de varios diámetros moleculares.

Fuerzas de Coulomb
Podemos conseguir que la intensidad de esas fuerzas aumente tratando de disminuir la distancia media entre las moléculas. Esto se puede lograr haciendo descender la temperatura, aumentando la presión o ambas cosas. Alcanzada una determinada temperatura, las moléculas comienzan a sentir las fuerzas de Van der Waals y aparece el estado líquido; si se sigue enfriando aparece el sólido.
El orden crece desde el gas al líquido, siendo el sólido el más ordenado.
Se trata de una red tridimensional en la que los nudos o vértices del entramado están ocupados por moléculas.
Todas las sustancias conocidas pueden presentarse en cualquiera de los tres estados de la materia (estados ordinarios y cotidianos en nuestras vidas del día a día). Otros estados, como el plasma, sólo se producen en los laboratorios o en el espacio interestelar.
De hecho, es el estado más común de la materia en el Universo, todas las estrellas están hechas de material que debido a las altísimas temperaturas, han adquirido el estado de plasma.
Puede que existan otros estados de la materia en situaciones poco conocidas y también estaríamos hablando del espacio exterior en el que, pudieran existir estrellas Quarks y Gluones formando una especie de materia extraña.

Estos son los estados de la materia que siempre nos enseñaban en el Colegio, sin embargo, hay otros que, menos conocido no están presentes en nuestra vida cotidiana y sólo se forman en condiciones especiales que, generalmente, no están presentes en nuestra atmósfera.
Si las temperaturas reinantes en las estrellas alcanzan miles de millones de grados, el estado de la materia es el plasma, el material más común del universo. Esa otra clase de materia a la que llamamos materia oscura (si finalmente existe) no sabemos en qué estado estará o de qué está conformada.

Plasma en ebullición en la superficie del Sol
En condiciones ordinarias de presión, la temperatura por debajo de la cual existe el líquido y/o sólido depende del tipo de sustancia.
Se denomina temperatura de ebullición o fusión la que corresponde a los sucesivos equilibrios (a presión dada) de fases: vapor ↔ líquido ↔ sólido. Estas temperaturas son muy variadas, por ejemplo, para los gases nobles son muy bajas; también para el oxígeno (O2) e hidrógeno (H2).
En cambio, la mayoría de las sustancias son sólidos en condiciones ordinarias (grasas, ceras, etc).
Las sustancias pueden ser simples y compuestas, según que la molécula correspondiente tenga átomos iguales o diferentes.
El número de las primeras es enormemente inferior al de las segundas.

El concepto de molécula, como individuo físico y químico, pierde su significado en ciertas sustancias que no hemos considerado aún. Entre ellas figuran las llamadas sales, el paradigma de las cuales es la sal de cocina.
Se trata de cloruro de sodio, por lo que cualquier estudiante de E.G.B. escribiría sin titubear su fórmula: Cl Na. Sin embargo, le podríamos poner en un aprieto si le preguntásemos dónde se puede encontrar aisladamente individuos moleculares que respondan a esa composición.
Le podemos orientar diciéndole que en el gas Cl H o en el vapor de agua existen moléculas como individualidades. En realidad y salvo casos especiales, por ejemplo, a temperaturas elevadas, no existen moléculas aisladas de sal, sino una especie de molécula gigante que se extiende por todo el cristal.
Este edificio de cristal de sal consiste en una red o entramado, como un tablero de ajedrez de tres dimensiones, en cuyos nudos o vértices se encuentran, alternativamente, las constituyentes, que no son los átomos de Cl y Na sino los iones Cl- y Na+.
El primero es un átomo de Cl que ha ganado un electrón, completándose todos los orbitales de valencia; el segundo, un átomo de Na que ha perdido el electrón del orbital s.
“Propiedades físicas” es una expresión de significado muy amplio: engloba todas las propiedades de las sustancias relacionadas a fenómenos físicos.
No tendría ningún sentido intentar estudiar todas las propiedades físicas a la vez; apenas para enumerarlas todas juntas ya sería consumidas a un espacio enorme.
En general establecemos objetivos de naturaleza práctica para delimitar nuestros estudios: las propiedades físicas que nos interesan en este momento son aquellas que utilizamos corrientemente en los trabajos comunes de laboratorio, como punto de fusión, punto de ebullición, solubilidad.
Estas propiedades están fuertemente asociadas con las fuerzas que mantienen las moléculas unidas unas a las otras, las que son llamadas fuerzas intermoleculares.
Los puentes de hidrógeno son especialmente fuertes entre las moléculas de agua y son la causa de muchas de las singulares propiedades de esta sustancia. Los compuestos de hidrógeno de elementos vecino al oxígeno y de los miembros de su familia en la tabla periódica, son gases a la temperatura ambiente: CH4, NH3, H2S, H2Te, PH3, HCl. En cambio, el H2O es líquida a la temperatura ambiente, lo que indica un alto grado de atracción intermolecular.
En la figura 6 se puede ver que el punto de ebullición del agua es 200 ºC más alto de lo que cabría predecir si no hubiera puentes de hidrógeno. Los puentes de hidrógeno juegan también un papel crucial en la estructura del ADN, la molécula que almacena la herencia genética de todos los seres vivos.
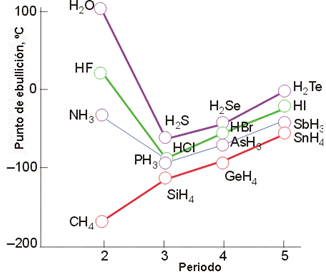
Figura 6. Variación de los puntos de ebullición de los hidruros moleculares.
Fuerzas Intermoleculares
El enlace que atrapa los átomos dentro de una molécula es el enlace covalente. Las fuerzas de atracción entre las moléculas son de naturaleza eléctrica. Fuerzas gravitacionales también existen, pero podemos despreciarlas por ser mucho menores que las fuerzas eléctricas. Analicemos ahora, las fuerzas que existen entre las moléculas. Estas fuerzas pueden ser divididas en dos tipos: Fuerzas de Van der Waals y Puente de Hidrógeno
Fuerzas de Van der Waals
Las fuerzas de atracción o repulsión entre entidades moleculares (o entre grupos dentro de la misma entidad molecular) diferentes de aquellas que son debidas a la formación de enlace o la interacción electroestática de iones o grupos iónicos unos con otros o con moléculas neutras.
Estudiemos los tipos principales:
Fuerza entre dipolos permanentes: Si la molécula de la sustancia contiene un dipolo permanente (debido a la polaridad de uno o más de sus enlaces covalentes), entonces podemos fácilmente ver como esas moléculas se atraen unas a otras: el lado positivo del dipolo de una molécula atrae al lado negativo del dipolo de la otra molécula. Esta fuerza existe, por tanto, entre moléculas polares (μ total ≠ 0).
Ejemplo:
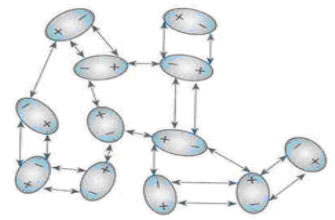
Fuerzas de London o fuerzas de dispersión: Es cuando las moléculas no contienen dipolos (son apolares).
Entonces, como es que logran atraerse?
Pensemos en una molécula como una entidad no estática, pero conteniendo electrones en constante movimiento; es razonable pensar que en un determinado momento la distribución en esa molécula puede no ser perfectamente simétrica y aparecen entonces pequeños dipolos instantáneos en este momento.
Esos dipolos desaparecerán en muy poco tiempo, pudiendo llevar a una molécula neutra o a otros dipolos, inclusive contrarios, pero en un corto espacio de tiempo en que ellos existen pueden inducir a la formación de dipolos contrarios en la molécula vecina, llevando a las dos a atraerse mutuamente.
Ejemplo:

Enlaces de Hidrógeno o Puentes de Hidrógeno: El átomo de hidrógeno tiene propiedades especiales por ser un átomo muy pequeño, sin electrones en el interior: por dentro de la capa de valencia existen apenas el núcleo del átomo y el protón.
Una de las propiedades que solo el átomo de hidrógeno presenta es la capacidad de ejercer una fuerza de atracción intermolecular llamada enlace de hidrógeno, o puente de hidrógeno. El enlace de hidrógeno solo puede ocurrir cuando el hidrógeno estuviese enlazado a un átomo pequeño y muy electronegativo: apenas F, O, N satisface las condiciones necesarias.
Cuando el hidrógeno enlazado a un átomo muy electronegativo, la densidad electrónica en torno del protón se establece bastante baja, esta de la molécula es entonces fuertemente atraída por los pares de electrones del F, O, N de otra molécula, estableciendo el enlace de hidrógeno.
Ejemplo:

Científicos de Austria recientemente publicaron un sobre la denominada fuerza de van der Waals, responsable de mantener unidas determinadas sustancias químicas a superficies metálicas.
Este estudio revela que varios modelos para la interacción entre películas orgánicas y finas capas metálicas en las que se colocan deben ser revisados. Dentro de las aplicaciones se encuentra la fabricación de semiconductores orgánicos, mucho más flexibles que los actuales inorgánicos.
Cuando los átomos de Cl y Na interaccionan por aproximarse suficientemente sus nubes electrónicas, existe un reajuste de cargas, porque el núcleo de Cl atrae con más fuerza los electrones que el de Na, así uno pierde un electrón que gana el otro. El resultado es que la colectividad de átomos se transforma en colectividad de iones, positivos los de Na y negativos los de Cl. Las fuerzas electromagnéticas entre esos iones determinan su ordenación en un cristal, el ClNa.
Por consiguiente, en los nudos de la red existen, de manera alternativa, iones de Na e iones de Cl, resultando una red mucho más fuerte que en el caso de que las fuerzas actuantes fueran de Van der Waals. Por ello, las sales poseen puntos de fusión elevados en relación con los de las redes moleculares.
Dejamos aquí el paseo por el fascinante mundo de la Química que, como la Física, es un universo en sí mismo.
Universo.org.es