Habíamos obtenido las ecuaciones de Friedmann para la cosmología y visto varios modelos cosmológicos, momento en el que dije que empezaría a justificar cómo se tomaban los datos para estudiar experimentalmente el universo.
A partir de ahí, comenzamos a tratar las bases de la física cuántica, viendo el campo de Schrödinger libre y con interacción, así como la solución armónica del mismo. En esta entrada veremos cómo es el campo de Schrödinger sometido a una interacción electrostática para describir el átomo, y veremos que los resultados serán acordes con la entrada en la que hicimos las mismas cuentas sin formalismo cuántico.
¿A dónde queremos llegar?:
Como comentaba, ya estudiamos los átomos monoelectrónicos en su momento, donde un electrón de carga -qp era atrído por Z protones de carga qp para dar lugar a un campo electrostático V dependiente de la distancia r entre ellos:

El radio resultante para la órbita del electrón en torno a los protones podía tomar varios valores discretos/cuantizados dependientes de un número n, frecuentemente referenciado como número cuántico orbital. La expresión obtenida fue concretamente:
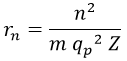
Para los objetivos que nos proponemos en esta entrada será particularmente útil definir el radio de Bohr rB para el átomo monoelectrónico como el que corresponde al primer nivel orbital:
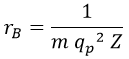
Por su parte, la energía que habíamos obtenido para el electrón responde a la fórmula:
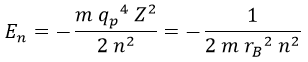
Importante tener claro que siempre será negativa.
Pues bien, en esta entrada intentaremos reproducir resultados coherentes con estos usando el formalismo cuántico. Veremos que uno de los dos datos no aparece con la misma relevancia en este nuevo punto de vista y justificaremos por qué para comprender mejor las diferencias entre el modelo de campo de Schrödinger y el clásico.
Planteando la ecuación:
Dado que en principio tenemos un sistema estático la energía será un autovalor del mismo, lo que como ya vimos nos permite decir que el estado del sistema será el producto de una función ψ que solo dependerá de las coordenadas espaciales y una exponencial compleja con la energía y el tiempo, todo ello multiplicado por el estado base I, que es la forma que emplearé para decir que tenemos un estado:
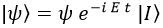
La ecuación de Schrödinger entonces queda de la forma:
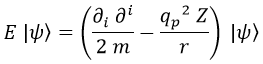
Ahora bien, por un lado tenemos derivadas parciales con respecto a las coordenadas espaciales i, pero por el otro tenemos la coordenada esférica r.
No podemos mezclar coordenadas para hacer cuentas, así que hay que decidir si usaremos cartesianas o esféricas desde un principio.
En este caso, por motivos bastante evidentes, recurriremos a esféricas.
El potencial de interacción es esféricamente simétrico: solo depende de la distancia del electrón al núcleo.
Consecuentemente, la función de onda solo dependerá del parámetro r y de absolutamente nada más si trabajamos en esféricas.
Así pues, lo siguiente que toca es reescribir las derivadas cartesianas como derivadas esféricas. Importantísimo recordar que no sirve con cambiar las derivadas segundas en unos parámetros por las derivadas segundas en otros. Para una explicación detallada de esto remito sobre gradientes con cambios de coordenadas.
Aquí reharé las cuentas de forma un poco más cutre porque no hace falta tanto nivel. Aplicando la regla de la cadena para y teniendo en cuenta que las derivadas no radiales no intervienen, podemos cambiar una derivada cartesiana ∂i por la radial ∂rmediante la regla de la cadena:
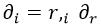
Aquí aprovecho para recordar que las derivadas parciales las representamos con comas abajo a la derecha. Derivar rrespecto a la coordenada espacial i no tiene mucho misterio, pero como estas entradas solo son un inciso en otras sobre relatividad usaré notación de índices y métrica de Minkowski, lo que lo lía un poco pero sirve para practicar.
En este formalismo, r sería:

Con lo que la derivada será:
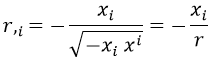
Así que el cambio de derivada finalmente queda como:
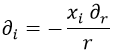
Si ahora intentamos sacar la derivada segunda llegamos a:
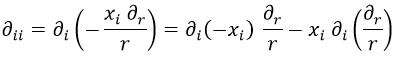
Y aquí hay que tener en cuenta dos cosas.
En el primer término, que una derivada así con ambos índices abajo involucra un cambio de signo.
En el segundo término, que la derivada se puede reescribir con la expresión obtenida antes. Así pues:
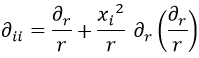
En la ecuación de Schrödinger, no obstante, no teníamos esto sino un laplaciano, que cumple para la métrica de Minkowski:
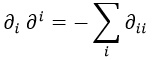
En métrica euclídea no haría falta un signo menos.
A partir de aquí:

Con esto técnicamente habríamos acabado, pero lo cierto es que es más cómodo escribir el resultado de otra forma.
Sin embargo, en vez de llegar hasta ella pondré cuál es y deduciremos que es equivalente a esta:

De modo que finalmente la ecuación de Schrödinger a resolver es:

Por comodidad, usaremos la notación de derivadas parciales con comas:
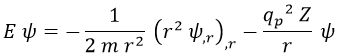
Y todavía podemos reescribirla más de forma homogénea (cosas sumadas e igualadas a 0 sin términos que no tengan ψ):
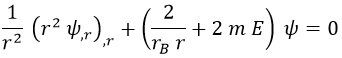
Nótese la introducción por conveniencia del radio de Bohr rB dado que teníamos todos los ingredientes necesarios.
¿Podríamos resolver esta ecuación diferencial por series de potencias tal cual está? Sí, y usaremos ese método. Pero antes podemos ahorrarnos trabajo.
El campo auxiliar:
Este problema es mucho más fácil de resolver si en vez de trabajar con el campo de Schrödinger ψ recurrimos a otro campo auxiliar φ tal que:
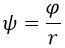
Dado que el campo de Schrödinger es el auxiliar dividido entre el radio, cabe esperar que el auxiliar sea proporcional a dicho radio. Esto será relevante.
De la relación expuesta se pueden inferir algunas otras:
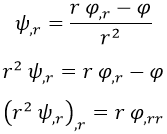
Y teniendo todo esto en cuenta podemos dejar la ecuación de Schrödinger con la siguiente apariencia, que en principio asusta menos:
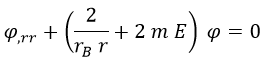
En el caso límite en el que r es prácticamente infinito, el término con rB es despreciable y la ecuación se reduce a:

Sabemos que las exponenciales complejas/funciones oscilantes son las únicas funciones que, tras ser derivadas dos veces, quedan proporcionalmente opuestas a ellas mismas, y podría parecer que es el caso.
Sin embargo, suceden dos cosas que deberían alertarnos para no tirar por ahí:
- Un electrón atraído por un núcleo no debería tener una función de onda oscilante en el radio, sino una que se atenue a medida que se aleje del núcleo.
- Como anticipamos, la energía es negativa, de modo que en realidad -2 m E es un número positivo.
Teniendo presentes estas consideraciones, debería quedar claro que la exponencial no será compleja y, por tanto, llegamos a la relación de proporcionalidad:
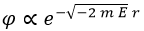
No hemos considerado la posibilidad de que el exponente llevase un + en vez de un – antes de la raíz porque entonces la función de onda podría valer infinito y no sería una probabilidad.
Llegados a este punto, podemos llamar P al factor de proporcionalidad y escribir:
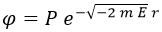
Sus derivadas serían entonces:
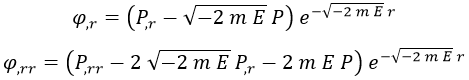
De modo que sustituyendo obtenemos una ecuación conocida como de tipo Laguerre para la función P:
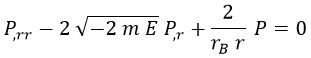
Para resolverla, suponemos que P es expresable como una serie de potencias de r sin término independiente, ya que especificamos que queríamos que la función fuese proporcional a r:
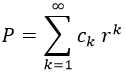
A partir de aquí, podemos expresar las operaciones que necesitaremos con la serie teniendo en cuenta los criterios usuales:
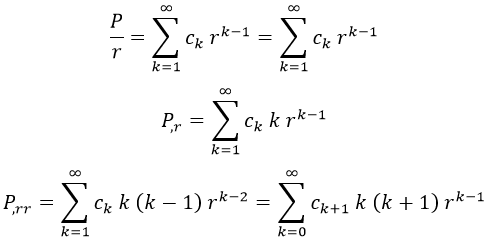
Nótese que en la última igualdad reescribimos todo para que el exponente final vuelva a ser k-1. Sustituyendo en la ecuación:

Y dando por hecho que lo que hay entre paréntesis tendrá que ser igual a 0 porque desde luego r no lo es, obtenemos la relación de recurrencia:
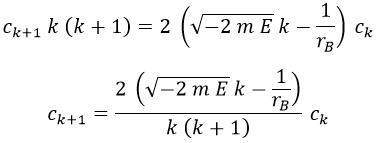
Si queremos que la solución solo tenga términos ck hasta el valor n, debe cumplirse necesariamente que:
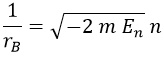
Cuando se cumple esta igualdad, el término ck existe pero el ck+1 y siguientes ya no.
Esto es análogo a lo que hicimos para cuantizar el oscilador armónico. Y del mismo modo despejando de aquí la energía asociada a un valor n, ¡obtenemos lo que tenemos que obtener!:
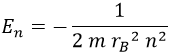
Consecuentemente, el campo auxiliar es expresable como:
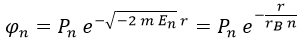
Aquí Pn es el polinomio tipo Laguerre asociado a un valor n.
Vemos además que lo que tasa cómo de rápido decae la exponencial es nada más y nada menos que el radio de Bohr rB.
En el modelo cutre que planteamos previamente supusimos que el electrón orbitaba en torno al núcleo como la Tierra en torno al Sol, y que dicha órbita tenía por radio el radio de Bohr en su nivel energético más bajo. Aquí, sin embargo, la cosa es conceptualmente bastante diferente.
En física cuántica las partículas son manifestaciones de campos que pueden ocupar, como es el caso, todo el espacio.
En este caso el electrón no orbita en torno al núcleo, sino que el campo electrón ψ está constantemente en todas partes, siendo su intensidad menor a medida que se aleja del núcleo.
El radio de Bohr en física cuántica no es más que el parámetro de referencia para indicar cómo decae el campo con el radio.
El órbital 1s:
Teniendo el campo auxiliar y recordando su relación con el de Schrödinger, podemos describir los estados orbitales del siguiente modo:
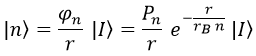
De entre todos estos estados, el menos energético sería el n=1.
Cuando eso sucede, el polinomio de Laguerre asociado es:
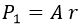
Así pues, el estado 1s es:
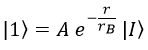
Falta calcular A, y para ello recordamos que la integral del módulo del campo al cuadrado tiene que dar 1 para que sea un campo de probabilidad:
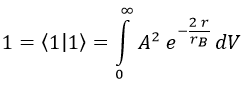
El diferencial de volumen dV podemos sacarlo rápidamente teniendo en cuenta que integramos en una esfera infinita y que la única componente relevante es la radial:
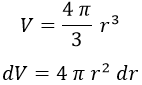
De modo que la cuenta que tenemos que hacer es:
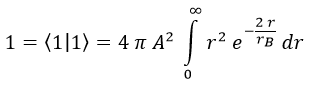
Para ello está bien recordar que mediante integración por partes se puede demostrar que:
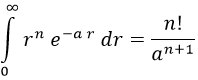
Consecuentemente:
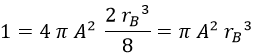
Y de aquí despejamos A:
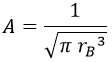
De modo que el orbital 1s queda definitivamente como:
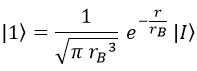
¿Y sabiendo esto cuál es la distancia promedio a la que estará el electrón del núcleo? ¿El radio de Bohr?
La respuesta es un poco diferente.
En promedio estará un 50% más lejos que dicho radio:
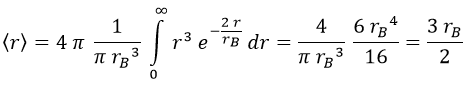
Transiciones orbitales:
Sustituyendo todos los datos pertinentes, sabíamos que la energía del electrón de un átomo monoelectrónico es, en electrónvoltios:
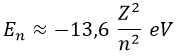
Consecuentemente, si dado un átomo de número atómico Z, un electrón hace una transición desde el orbital n hasta elm, la variación de su energía es:
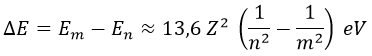
Si el orbital m es mayor que el n, el electrón gana energía para ascender. Si es menor, la libera. En particular, la energíaWe necesaria para extraer un electrón del orbital 1s de un átomo de hidrógeno resulta ser:
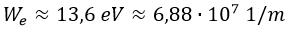
Esto es debido a que asciente desde n=1 hasta m=∞.
La energía que el electrón absorbe o libera típicamente tiene forma de fotón, y la longitud de onda de un fotón con la energía de extracción calculada es:
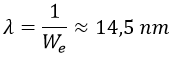
Decenas de nanometros es la longitud de onda característica de la luz ultravioleta, con lo que cada vez que ionizamos un átomo de hidrógeno separando su electrón y su protón emitimos luz muy energética.
Como imaginaréis, no es un proceso particularmente frecuente en la naturaleza. Cuando los átomos de hidrógeno pierden electrones lo habitual es que sea debido a que los recoge otro átomo, no a que se escapen de repente. Los aventureros podéis calcular aproximadamente cuál sería la probabilidad de que un electrón atravesase por efecto túnel una barrera de 1 nanometro de 13,6 eV de potencial usando las fórmulas.
Los átomos más grandes que el hidrógeno tienen valores mayores de n, lo que reduce drásticamente la energía de sus electrones aumentando su longitud de onda y permitiendo a los fotones que emiten entrar en el rango visible, de centenas de nanometros.
No es casualidad que los colores que veamos coincidan en gran medida con las longitudes de onda de las transiciones de la inmensa mayoría de los átomos: hemos evolucionado porque nos interesa ver eso para sobrevivir.
Cuando la luz golpea un material, las longitudes de onda que pueden absorber los átomos del material desaparecen, y en el reflejo de esa luz percibimos que faltan. Esas longitudes de onda son lo que denominamos espectro luminoso de los átomos, y sirven para caracterizarlos sin lugar a dudas.
Solo el hidrógeno absorbe los colores que absorbe el hidrógeno, y solo el helio absorbe los colores que absorbe el helio.

Algunas líneas espectrales del hidrógeno.
No hay comentarios:
Publicar un comentario