En esta entrada vamos a presentar las evidencias experimentales de los niveles atómicos de los átomos. Para ello haremos una breve discusión del modelo atómico de Bohr y sus pruebas más evidentes, los espectros atómicos. Y será interesante ponerse en el lugar de los señores que se enfrentaron con el problema de demostrar que el modelo de Bohr realmente implicaba hechos comprobables experimentalmente.
Motivando a Bohr
Pongámonos en perspectiva, hacia 1913 Niels Bohr propone el modelo atómico que lleva su nombre y la situación era como sigue:
1.- Se había encontrado que los elementos químicos emitían ciertos espectros donde se identificaban líneas de colores definidos. (Esto en el rango visible del espectro electromagnético, también se dan emisiones en las zonas infrarrojas y ultravioletas)
El color de la luz está asociado con su frecuencia  y esta a su vez con la energía de los fotones que conforman dicha luz (de ese color) a través de la fórmula de Planck (propuesta en 1900):
y esta a su vez con la energía de los fotones que conforman dicha luz (de ese color) a través de la fórmula de Planck (propuesta en 1900):
La frecuencia  de una onda electromagnética y su longitud de onda
de una onda electromagnética y su longitud de onda  están relacionadas por la relación:
están relacionadas por la relación:
Por tanto, si uno tiene el espectro de un átomo donde sólo se emiten en determinados colores hay que entender porqué sólo se dan dichos colores y no cualquier otro.
Por ejemplo, para el Hidrógeno tenemos:
Recordemos que los nanómetros son  metros y esos números indican la longitud de onda
metros y esos números indican la longitud de onda
La energía de cada línea se puede calcular con la mencionada fórmula:
2.- Por otro lado, como se vio se tenía constancia de que el átomo estaba formado por un núcleo cargado positivamente y electrones “orbitando” a su alrededor, el modelo de Rutherford.
Pero este modelo tiene un grave problema, según la física clásica una carga acelerada, por ejemplo un electrón orbitando alrededor de un núcleo, debería de emitir radiación electromagnética de forma continua.
Esto ocasionaría que el electrón perdiera energía continuamente y el radio de la órbita iría decreciendo hasta precipitarse al núcleo.
3.- Aún no se tenía un entendimiento profundo de la mecánica cuántica (la ecuación de Schrödinger fue propuesta en 1925), que es la teoría que explica a la perfección el átomo, así que había que proponer modelos que explicaran tanto la existencia de los espectros como la estabilidad atómica. Y entonces llego Bohr.
El modelo de Bohr
Bohr propone un modelo heurístico que tiene “exige” la estabilidad atómica y es capaz de explicar los espectros. Repasemos dicho modelo:
1.- Un electrón en un átomo no puede estar orbitando en cualquier radio respecto al núcleo. Sólo lo hará en aquellos radios llamados estacionarios donde el electrón no emite radiación electromagnética.
Estas órbitas estacionarias tienen una energía definida, a estas se las denomina niveles de energía.
2.- Un electrón puede pasar de un nivel de energía 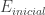 a otro
a otro 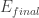 únicamente absorbiendo o emitiendo radiación con la energía justa correspondiente a la diferencia de niveles:
únicamente absorbiendo o emitiendo radiación con la energía justa correspondiente a la diferencia de niveles:
3.- Bohr consiguió determinar los niveles de energía de los electrones en un átomo dado con la fórmula:
donde la Z corresponde al número atómico del elemento con el que estemos trabajando (el número de protones del núcleo) y la energía está medida en electronVoltios.
Este modelo es semicuántico porque asume que los electrones verifican las leyes clásicas de la física sólo en un número discreto de órbitas que verifican que su energía está dada por la fórmula anterior. Posteriormente, la mecánica cuántica derivó los niveles de energía de manera satisfactoria.
El modelo resuelve los problemas planteados por la situación inicial:
- Los espectros tienen un conjunto discreto de líneas de diferentes colores (diferentes frecuencias) porque corresponden al salto de niveles superiores de energía a niveles inferiores.
- Los átomos son estables porque se exige que en los distintos niveles de energía discretos los electrones no emitan radiación electromagnética de forma continua.
Por ejemplo, para el Hidrógeno (Z=1) tenemos que los niveles de energía predichos por el modelo son:

La energía del nivel fundamental es por tanto -13.6 eV, lo que significa que si un electrón en dicho nivel se topa con un fotón de energía 13.6 eV este saltará y escapará de la atracción del núcleo, es lo que se llama energía de ionización.
Un esquema de cómo se forma el espectro del Hidrógeno viene representado por:
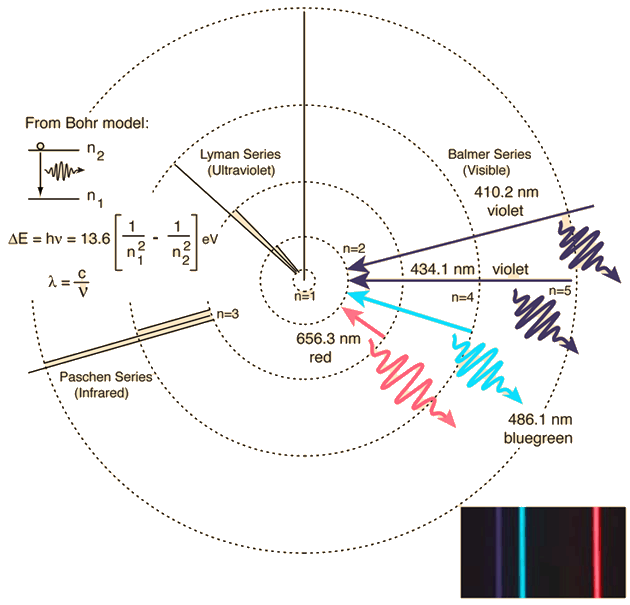
Pero uno puede pensar que el modelo está construido ex profeso para la explicación de los espectros y los niveles de energía no son más que un artefacto del modelo. Por lo tanto hay que encontrar una prueba experimental alternativa de la existencia de los mismos.
Disgresión: Elástico e inelástico
En los experimentos de la física de partículas, atómica, molecular o nuclear los físicos tienen la posibilidad de hacer realidad el sueño de todo niño con un juguete nuevo: “Para saber lo que hay dentro hay que romperlo“
Está claro que el procedimiento aquí es un pelín más avanzado y lo que hacemos es lanzar “proyectiles” (partículas alfa, electrones, etc) contra el elemento que queremos analizar y luego estudiamos los productos de la colisión. Pero cuando hablamos de colisiones hay que definir lo que es una colisión elástica y una colisión inelástica.
Colisiones
Supongamos que tenemos un blanco al que le lanzamos una partícula con una energía de 5 unidades de energía (pon la que más te guste). Se produce la colisión y vemos que la dirección del movimiento de la partícula lanzada ha cambiado (a eso se llama dispersión o scattering).
Colisión elástica
Si después de la colisión la partícula (que ha sido desviada) sigue teniendo 5 unidades de energía, entonces diremos que la colisión es elástica.
Colisión inelástica
Si después de la colisión la partícula (que ha sido desviada) tiene una energía menor de 5 unidades de energía, diremos que la colisión es inelástica.
Está claro que en el caso elástico tanto el “proyectil” como el blanco tienen la misma energía que al inicio por separado. En el caso inelástico parte de la energía del proyectil es transferida al blanco.
Jugando con el Helio
Ahora supongamos la siguiente situación:
1.- Tenemos Helio en forma gaseosa.
2.- A esta muestra le lanzamos electrones a 200 eV (los proyectiles).
3.- Luego estudiamos los productos de la colisión y vemos con qué energía final nos llegan los electrones (no nos interesa aquí el ángulo de desviación de la trayectoria inicial ni nada por el estilo). Es decir, nos ponemos a contar todos los electrones que después de atravesar la muestra de Helio tienen una determinada energía.
Si graficamos el resultado obtenemos lo siguiente:

Lo que vemos en la gráfica es lo siguiente:
1.- Tenemos un pico centrado en 200 eV, es decir, todos esos electrones no han colisionado o si colisionan lo hacen de forma elástica (tienen la misma energía que de partida).
2.- Luego tenemos un pico alrededor de 179 eV. Eso quiere decir que llegan electrones que han perdido en las colisiones 21 eV.
3.- Tenemos otro pico alrededor de 177 eV. Eso quiere decir que llegan electrones que han perdido en las colisiones 23 eV.
Pero la energía no se pierde, el Helio se ha tenido que quedar con ella. Por lo tanto eso quiere decir que el Helio ha pasado de un estado fundamental (su mínima energía) a un estado donde los electrones de su corteza han subido a un nivel con una energía de 21 o 23 eV mayor (dependiendo del caso).
Lo interesante de esto es que las colisiones inelásticas producen picos aislados y discretos. Es decir, los electrones inicialmente de 200 eV o pierden 21 o pierde 23 eV pero ningún valor intermedio.
Eso indica que existen los niveles de energía, y efectivamente, si uno calcula los niveles del Helio encuentra:

Donde vemos que los primeros niveles de energía están entre 21 y 23 eV de diferencia respecto al nivel fundamental.
Evidentemente este experimento puede ser mejorado en multiples aspectos, pero lo importante es que su resultado obliga a mejorarlo porque se ha obtenido que la transferencia de energía de los electrones incidentes a la muestra de Helio no puede tener cualquier valor sino sólo aquellos correspondientes a las diferencias de energía entre los niveles teóricos del Helio.
Por lo tanto este es el experimento más simple que puede ser puesto encima de la mesa como una confirmación alternativa a los espectros atómicos (y consistente con estos) sobre la existencia de los niveles de energía atómicos.
Si les ha gustado esto no dejéis de leer el experimento de Franck-Hertz que es la base de o expuesto aquí.
Esperamos que os haya interesado el tema y haber sabido transmitir la esencia del experimento.
Nos seguimos leyendo…
http://cuentos-cuanticos.com/
No hay comentarios:
Publicar un comentario